吉瑞替尼/吉列替尼(Gilteritinib)疗效再次证实!加诱导和巩固化疗耐受性良好,复合完全缓解率(CRc)高达79.7%!
发布时间:2023-03-09 点击量: 次
SOHO会议上再次公布吉瑞替尼/吉列替尼疗效
在2022年第10届美国血液肿瘤学会(SOHO)年会上,根据一项1期试验(NCT02236013)的数据,吉瑞替尼/吉列替尼(Gilteritinib)与诱导和巩固化疗相结合,在新诊断的急性髓细胞白血病(AML)患者中产生了应答,包括FLT3突变的患者。在所有可评估的AML患者(n = 78)中,综合完全缓解(CRc)率为79.7%。具体来说,CR率为54.4%,血液不完全恢复(CRi)率为21.5%,血小板不完全恢复(CRp)率为3.8%。在可评估的患者中FLT3突变(n = 44),CRc、CR、CRi和CRp的发生率分别为90.9%、70.5%、13.6%和6.8%。
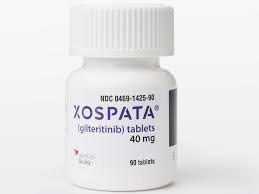
吉瑞替尼/吉列替尼加诱导和巩固化疗耐受性良好,CRc高达79.7%
背景:吉瑞替尼/吉列替尼(Gilteritinib),口服FLT3抑制剂,在FLT3患者中表现出抗白血病反应+复发/难治性AML(急性髓系白血病)反应。目标:每日一次的吉瑞替尼/吉列替尼加强化化疗治疗新诊断(ND) AML的1期研究的最终数据。
设计:这项由4部分组成的开放性研究(NCT02236013)评估了吉瑞替尼/吉列替尼的剂量/方案以及替代蒽环类药物治疗的效果。
干预:吉瑞替尼/吉列替尼加7+3伊达比星或柔红霉素诱导,加≤3个周期的大剂量阿糖胞苷和吉瑞替尼/吉列替尼巩固治疗,以及巩固或移植后2年的单药吉瑞替尼/吉列替尼维持治疗。
患者:成人ND AMLFLT3登记时不需要突变(排除已知的核心结合因子融合)。
主要结果测量:安全性,耐受性,药代动力学,抗白血病效应。
结果:80名患者被分配到吉瑞替尼/吉列替尼组(安全性分析组,n = 78[年龄23-77岁];FLT3+,n=44 [FLT3-ITD,n=33])。中位随访时间为37.7个月。80名患者中有27名(33.8%)进行了研究中HSCT(FLT3mut+,26/44 [59.1%])。15/78 (19.2%)例患者出现剂量限制性毒性(200毫克/天队列:中性粒细胞减少症,n = 1;中性粒细胞减少性结肠炎,n=1)。最大耐受剂量为120 mg/d。在整个研究中,AE导致24.4%的患者停用吉瑞替尼/吉列替尼。在治疗结束时,总人群中的复合完全缓解率(CRc:完全缓解[CR] + CR伴不完全血液学恢复[CRi] + CR伴不完全血小板恢复[CRp])、CR、CRi和CRp分别为79.7%、54.4%、21.5%和3.8%,其中FLT3mut+病人。总的来说(n=79)和FLT3mut+人群(n=44),60天死亡率分别为1.3%和0%,中位(95% CI)无病生存期为15.1 (9.5,31.9)和15.1 (4.9,31.9)个月。总的来说(n=69)和FLT3mut+接受治疗的人群(n=41)≥80 mg/d,中位(95% CI) OS分别为38.6 (21.7,NE)和45.9 (30.8,NE)个月,估计的3年OS率为56.0%和60.1%。蒽环类药物的选择对CRc率或毒性没有实质性影响。在使用吉瑞替尼/吉列替尼实现CRc的患者中≥120毫克/天,FLT3-ITD的突变清除率(总计FLT3ITD:巩固后野生型信号比率≤10–4)为84.6% (11/13)。
结论:吉瑞替尼/吉列替尼加诱导和巩固化疗耐受性良好,FLT3-ITD清除率和nd患者的长期存活率FLT3mut+AML,支持正在进行的对照当前标准测试该方法的随机试验。
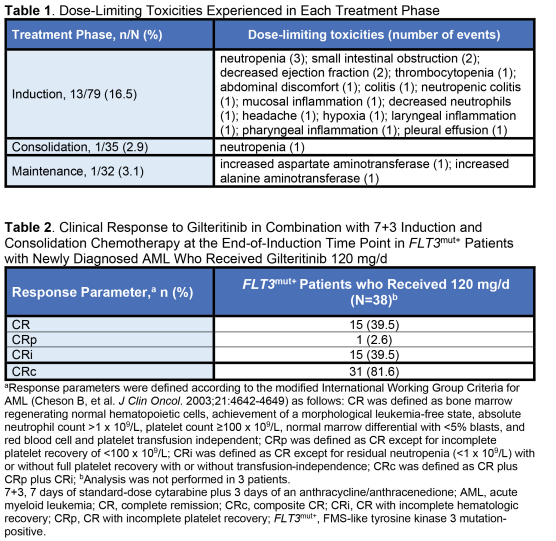
美国FDA批准的吉瑞替尼/吉列替尼治疗白血病的疗效
2018年11月28日,美国食品药品监督管理局(FDA)批准吉瑞替尼/吉列替尼(XOSPATA,Astellas Pharma US Inc .)用于治疗经FDA批准的测试检测出FLT3突变的复发或难治性急性髓细胞白血病(AML)的成年患者。FDA还批准了一个伴随诊断的扩大适应症,包括与吉瑞替尼/吉列替尼一起使用。由Invivoscribe Technologies,Inc .开发的LeukoStrat CDx FLT3突变检测用于检测AML患者的FLT3突变。吉瑞替尼/吉列替尼的批准是基于ADMIRAL试验(NCT02421939)的中期分析,该试验包括138名复发或难治性AML的成年患者,通过LeukoStrat CDx FLT3突变检测发现FLT3 ITD、D835或I836突变。吉尔替尼以每日120 mg的剂量口服给药,直至出现不可接受的毒性或缺乏临床益处。经过4.6个月的中位随访(范围:2.8至15.8),29名患者实现了完全缓解(CR)或部分血液学恢复(CRh)的CR(21%,95% CI: 14.5,28.8)。在基线时依赖红细胞(RBC)和/或血小板输注的106例患者中,33例(31.1%)在基线后的任何56天期间变得不依赖红细胞和血小板输注。在基线时不依赖红细胞和血小板输注的32例患者中,17例(53.1%)在基线后的56天内保持不依赖输血。
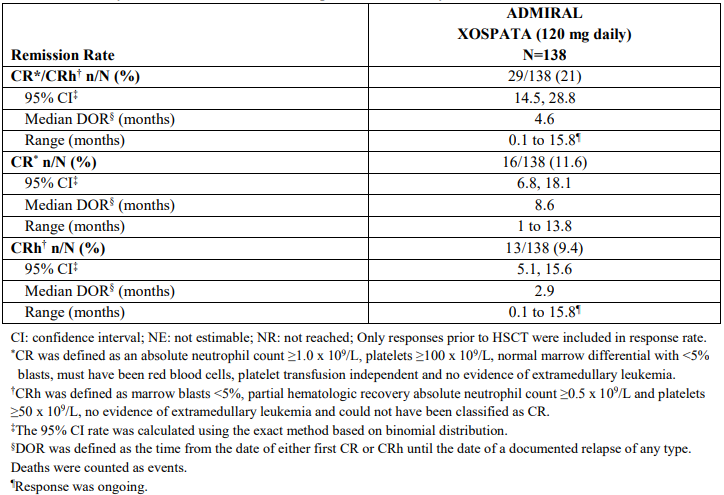
吉瑞替尼/吉列替尼用药简要说明
适应症:吉瑞替尼/吉列替尼是一种激酶抑制剂,适用于治疗经FDA批准试验检测出FLT3突变的复发性或难治性急性髓性白血病(AML)成人患者。用药方法:120毫克口服,每日一次。
副作用:最常见的不良反应(≥20%)为转氨酶升高、肌痛/关节痛、疲劳/不适、发热、粘膜炎、水肿、皮疹、非感染性腹泻、呼吸困难、恶心、咳嗽、便秘、眼部疾病、头痛、头晕、低血压、呕吐和肾功能损害。
注意事项:•后部可逆性脑病综合征(PRES):在出现PRES的患者中停用吉瑞替尼/吉列替尼。
•延长QT间隔时间:在QTcF >500 msec的患者中中断并减少吉瑞替尼/吉列替尼剂量。纠正低钾血症或吉瑞替尼/吉列替尼给药前和给药期间出现低镁血症。
•胰腺炎:中断并减少胰腺炎患者的剂量。
•胚胎-胎儿毒性:吉瑞替尼/吉列替尼对孕妇给药时可能会对胎儿造成伤害。告知胎儿的潜在风险并使用有效的避孕方法。
禁忌症:对吉瑞替尼/吉列替尼或任何赋形剂过敏。临床试验中已观察到过敏反应。
药物相互作用:•联合P-gp和强效CYP3A诱导剂:避免同时使用。
•强效CYP3A抑制剂:考虑替代疗法。如果不能避免合用强效CYP3A抑制剂,则应更频繁地监测患者的吉瑞替尼/吉列替尼不良反应。
•P-gp,BCRP,OCT1底物:当与吉瑞替尼/吉列替尼联合给药时,按照临床指示减少底物剂量。
吉瑞替尼/吉列替尼上市及价格、仿制药情况
2021年2月4日,中国国家药品监督管理局(NMPA)批准使用富马酸吉瑞替尼/吉列替尼(Gilteritinib)治疗患有复发性或难治性(耐药性)急性髓系白血病(AML)的成人患者,这些患者携带FMS样酪氨酸激酶3(FLT3)突变,这些突变通过有效的检测方法进行检测。目前吉瑞替尼/吉列替尼已经在国内上市,但是并未纳入医保,如果患者需要可以去医院自费购买,但是价格十分高昂,大约在七万元左右,具体价格请咨询当地医院药房。
国外的吉瑞替尼/吉列替尼原研药更加高昂,例如香港版原研药价格在九万左右,欧洲版原研药高达二十多万,普通患者根本无法承担。但是值得欣慰的是,吉瑞替尼/吉列替尼已经有国外仿制药,主要是老挝仿制药,价格大约五千多元,相对来说这个价格还是相当便宜了。就药品成分来说国内外的吉瑞替尼/吉列替尼原研药同仿制药药物成分一致。
参考资料:1.FDA approves gilteritinib for relapsed or refractory acute myeloid leukemia (AML) with a FLT3 mutatation
2.AML-256 A Phase 1 Study of Gilteritinib in Combination With Induction and Consolidation Chemotherapy in Patients With Newly Diagnosed Acute Myeloid Leukemia: Final Study Results
Author links open overlay panelKeith W. Pratz MD 1, Mohamad Cherry MD, MS 2, Nikolai A. Podoltsev MD, PhD 3,
3.OncLive:Gilteritinib Induces Encouraging Responses in Newly Diagnosed FLT3-Mutated AML

